در فیزیک اتمی ، یک عدد کوانتومی مغناطیسی یک عدد کوانتومی است که برای تشخیص حالتهای کوانتومی یک الکترون یا ذره دیگر با توجه به تکانه زاویهای آن در امتداد یک محور معین در فضا استفاده میشود. عدد کوانتومی مغناطیسی مداری ( ml یا m [ a ] ) اوربیتالهای موجود در یک زیر پوسته معین از یک اتم را متمایز میکند. این مولفه تکانه زاویهای مداری را مشخص میکند که در امتداد یک محور معین قرار دارد، که معمولاً محور نامیده میشود ، بنابراین جهت مدار را در فضا توصیف میکند. عدد کوانتومی مغناطیسی اسپین m s مولفه محور تکانه زاویه ای اسپین را برای ذره ای با عدد کوانتومی اسپین s مشخص می کند . برای یک الکترون، s 1 ⁄ 2 است و m s یا + 1 ⁄ 2 یا − 1⁄ 2 است که اغلب «spi-up» و «spi-dow» یا α و β نامیده می شود. [ 1 ] [ 2 ] اصطلاح مغناطیسی در نام به گشتاور دوقطبی مغناطیسی مرتبط با هر نوع تکانه زاویه ای اشاره دارد، بنابراین حالت هایی که اعداد کوانتومی مغناطیسی متفاوتی دارند، انرژی را در یک میدان مغناطیسی مطابق با اثر زیمن تغییر می دهند . [ 2 ]
چهار عدد کوانتومی که معمولاً برای توصیف حالت کوانتومی یک الکترون در یک اتم استفاده میشود، عدد کوانتومی اصلی ، عدد کوانتومی آزیموتال (اوربیتال) است. 



سایر اعداد کوانتومی مغناطیسی نیز به طور مشابه تعریف میشوند، مانند mj برای جزء محور ، تکانه زاویهای الکترونیکی j ، [ 1 ] و mI برای اسپین هستهای I. [ 2 ] اعداد کوانتومی مغناطیسی برای نشان دادن مجموع یک سیستم از ذرات، مانند ML یا mL برای کل تکانه زاویهای مداری محور همه الکترونهای یک اتم، با حروف بزرگ نوشته میشوند. [ 2 ]
اشتقاق
[ ویرایش ]
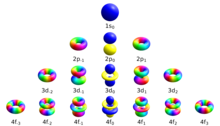
این اوربیتال ها دارای اعداد کوانتومی مغناطیسی هستند


مجموعه ای از اعداد کوانتومی مرتبط با حالت های انرژی اتم وجود دارد. چهار عدد کوانتومی



معادله دیفرانسیل برای












رابطه بین اعداد کوانتومی
مداریارزش هاتعداد مقادیر برای
به عنوان جزئی از تکانه زاویه ای
[ ویرایش ]

تصویر تکانه زاویه ای مداری مکانیکی کوانتومی. مخروط ها و صفحه جهت گیری های احتمالی بردار تکانه زاویه ای را نشان می دهند



محور مورد استفاده برای مختصات قطبی در این تحلیل به صورت دلخواه انتخاب می شود. عدد کوانتومی




این جزئی از تکانه زاویه ای مداری کل الکترون اتمی است

که




تاثیر در میدان های مغناطیسی
[ ویرایش ]
عدد کوانتومی


از آنجایی که هر الکترون دارای یک گشتاور مغناطیسی در یک میدان مغناطیسی است، در معرض گشتاوری خواهد بود که تمایل به ایجاد بردار دارد.L
همچنین ببینید
[ ویرایش ]
- عدد کوانتومی
- عدد کوانتومی آزیموتالی
- عدد کوانتومی اصلی
- عدد کوانتومی را بچرخانید
- عدد کوانتومی تکانه زاویه ای کل
- پوسته الکترونی
- مکانیک کوانتومی پایه
- اتم بور
- معادله شرودینگر
https://en.wikipedia.org/wiki/Magnetic_quantum_number#Effect_in_magnetic_fields







 در این وبلاگ به ریاضیات و کاربردهای آن و تحقیقات در آنها پرداخته می شود. مطالب در این وبلاگ ترجمه سطحی و اولیه است و کامل نیست.در صورتی سوال یا نظری در زمینه ریاضیات دارید مطرح نمایید .در صورت امکان به آن می پردازم. من دوست دارم برای یافتن پاسخ به سوالات و حل پروژه های علمی با دیگران همکاری نمایم.در صورتی که شما هم بامن هم عقیده هستید با من تماس بگیرید.
در این وبلاگ به ریاضیات و کاربردهای آن و تحقیقات در آنها پرداخته می شود. مطالب در این وبلاگ ترجمه سطحی و اولیه است و کامل نیست.در صورتی سوال یا نظری در زمینه ریاضیات دارید مطرح نمایید .در صورت امکان به آن می پردازم. من دوست دارم برای یافتن پاسخ به سوالات و حل پروژه های علمی با دیگران همکاری نمایم.در صورتی که شما هم بامن هم عقیده هستید با من تماس بگیرید.